Значение сосудистых реконструкций в онкологической практике у больных с выраженной сопутствующей патологией
Гранов А.М., Гранов Д.А., Полысалов В.Н., Школьник М.И., Таразов П.Г., Майстренко Д.Н., Павловский А.В.
Российский научный центр радиологии и хирургических технологий МЗ РФ, Санкт-Петербург, Россия
Опубликовано: Журнал «Онкохирургия», 2012, том 4, №3.
В статье рассмотрены вопросы сосудистых реконструкций в онкологической практике.
Актуальность проблемы определяется увеличением числа запущенных форм злокачественных опухолей на фоне существующей тяжелой соматической патологии.
Цель работы: повысить радикальность оперативного вмешательства на этапах комбинированного лечения ряда онкологических заболеваний за счет применения реконструкций магистральных сосудов, увеличить процент операбельности, оптимизировать циторедукцию, а также улучшить качество жизни онкологических больных при сопутствующих заболеваниях магистральных артерий конечностей.
Материал и методы. Проведен анализ результатов операций у 377 больных раком органов гепатопанкреатобилиарной зоны (ГПБЗ) и у 622 пациентов с местно-распространенным раком почки, получавших лечение в РНЦ РХТ МЗ РФ с 2006 по 2012 гг.
Результаты. Реконструкции магистральных сосудов потребовались у 54 (14,3%) больных раком ГПБЗ и у 46 (7,4%) раком почки. Реваскуляризацию нижних конечностей проводили у 111 пациентов на фоне стойкой ремиссии. Интраоперационная летальность при реконструкциях магистральных сосудов во время операций при раке органов ГПБЗ составила 0%, годичная выживаемость – 70,4%. Отдаленные результаты соответствовали выживаемости больных тех же стадий заболевания, но без поражения магистральных сосудов ГПБЗ.
Реконструкция нижней полой вены при местно-распространенном раке почки осложнилась у одного (2,1%) больного ТЭЛА (была выполнена открытая тромбэмболэктомия из легочной артерии). Летальность – 0%, годичная выживаемость – 84,7%.
Госпитальная летальность при реконструкциях магистральных артерий нижних конечностей у онкологических больных – 0%. Осложнения (2,7%) – нагноения раны. Отдаленные результаты были сопоставимы с больными, не страдающими онкологическими заболеваниями. Следует подчеркнуть, что 32 пациентам с онкопатологией в стадии стойкой ремиссии было выполнено стентирование аневризм брюшного отдела аорты. Осложнений не было. Госпитальная летальность – 0%.
Выводы. Использование сосудистых реконструкций в онкологической практике позволяет: расширить контингент больных, которым можно выполнить радикальное хирургическое лечение; увеличить возможности циторедукции, которая при местно-распространенных формах рака в значительной мере повышает эффективность комбинированного лечения основного заболевания: улучшить качество жизни онкологических больных.
КЛЮЧЕВЫЕ СЛОВА: реконструкции магистральных сосудов, рак печени, рак поджелудочной железы, рак почки, атеросклероз.
Введение
Актуальность проблемы определяется устойчивой тенденцией к увеличению заболеваемости злокачественными опухолями. Сосудистая хирургия и онкология имеют три основные области взаимопроникновения:
- реконструкции сосудов при местно-распространенных злокачественных опухолях органов гепатопанкреатобилиарной зоны;
- реконструкции сосудов при местно-распространенных злокачественных опухолях почек;
- реконструкции сосудов при заболеваниях магистральных артерий у онкологических больных.
Заболеваемость злокачественными опухолями гепатопанкреатобилиарной зоны (ГПБЗ) составляет 19,9 на 100 тыс. населения [2]. Резектабельность опухоли ГПБЗ [7] в значительной мере определяется объективными и субъективными возможностями реконструкций магистральных сосудов. Под субъективными возможностями подразумевается готовность коллектива врачей, работающих в лечебном учреждении, к сложным сочетанным вмешательствам на печени, поджелудочной железе и магистральных сосудах, вплоть до аутотрансплантации печени. Объективные возможности определяются тем, что лишь 20% пациентов с первичными опухолями этой локализации являются операбельными на момент первичного выявления ввиду экстраорганного распространения процесса [6]. В последнее десятилетие в среде хирургов, активно оперирующих на органах ГПБЗ, преобладает мнение о том, что сосудистая инвазия не является принципиальным противопоказанием к радикальной операции, однако, подход к принятию решения о подобных вмешательствах должен быть взвешенным [3, 5, 7-10].
Рак почки встречается у 18,2 на 100 тыс. населения [2]. Радикальность лечения этого заболевания определяется возможностями хирургического метода. Местно-распространенная форма заболевания встречается в 25-30%. У 4-15% больных раком почки заболевание осложняется продолженным опухолевым тромбом в нижней полой вене (НПВ) [1, 3, 4]. Возможность симультантной тромбэктомии из НПВ и выполнение ее резекции с последующей пластикой определяют результаты лечения больных раком почки.
Реконструкции магистральных артерий нижних конечностей применяют у онкологических больных, страдающих облитерирующим атеросклерозом сосудов нижних конечностей, находящихся в стадии стойкой ремиссии основного заболевания и имеющих оптимистичный прогноз.
Цель работы
Реконструкции сосудов при местно-распространенных злокачественных опухолях органов ГПБЗ, а также при раке почки имели целью повысить радикальность оперативного вмешательства на этапах комбинированного лечения онкологических больных, а также оптимизировать циторедукцию. Кроме того, реконструкции сосудов у онкологических больных, страдающих также заболеваниями магистральных артерий конечностей, направлены на повышение качества их жизни.
Материал и методы
В ходе нашей работы в Российском научном центре радиологии и хирургических технологий (РНЦРХТ) за 2006-2012 гг. были оперированы 377 больных с онкологическими заболеваниями органов ГПБЗ. Им были выполнены радикальные оперативные вмешательства (Табл. 1).
Таблица 1. Характеристика оперированных больных в зависимости от патологии (2006-2012 гг.).
| Вид патологии | Характер и объем операции | Число больных (n=377) |
|---|---|---|
| Рак поджелудочной железы | Гастропанкреатодуоденальная резекция | 99 |
| Дистальная резекция | 36 | |
| Рак печени и желчных протоков | Обширные резекции | 68 |
| Экономные резекции | 77 | |
| Метастатические поражения печени | Обширные резекции | 13 |
| Экономные резекции | 70 |
Реконструкции магистральных сосудов во время радикальных оперативных вмешательств на органах ГПБЗ потребовались у 54 (14,3%) пациентов.
Радикальных оперативных вмешательств по поводу местно-распространенного рака почки в нашем центре с 2006 по 2012 гг. было выполнено у 622 больных. У 46 (7,4%) из них потребовались реконструктивные оперативные вмешательства на НПВ.
Реваскуляризацию нижних конечностей у онкологических больных в РНЦРХТ за 2006-2010 гг. проводили в 81 наблюдении (из них 11 – экстренные ангиохирургические вмешательства).
Результатом взаимопроникновения и взаимодополнения нескольких специальностей является мультидисциплинарный подход в лечении больных гепатоцеллюлярным раком на фоне первичного билиарного цирроза. В нашем центре было пролечено 6 таких больных.
Методы. Реконструкцию магистральных сосудов ГЛБЗ при радикальных оперативных вмешательствах по поводу злокачественных опухолей поджелудочной железы, печени и желчевыводящих протоков выполняли как на венах, так и на артериях (Табл. 2).
Таблица 2. Варианты резекций магистральных сосудов гепатопанкреатобилиарной зоны (n=54).
| Варианты резекций сосудов | Характер операции | Число больных | |
|---|---|---|---|
| Панкреатодуоденальная резекция |
Резекция печени |
||
| Воротной вены | 18 | 15 | 33 |
| Печеночных артерий | 4 | 4 | 8 |
| Нижней полой вены | 3 | 10 | 13 |
| Всего | 25 | 29 | 54 |
Как видно из таблицы, наиболее часто применяли резекцию воротной вены, что объясняется анатомическими особенностями ГПБЗ. Артерии реже всего подвергались инвазии опухолями поджелудочной железы или печени. Артериальные реконструкции применяли не только при радикальных оперативных вмешательствах по поводу злокачественных опухолей ГПБЗ. У 6 больных выполнена транспозиция правой печеночной артерии в левую печеночную артерию как этап налаживания эффективной длительной региональной химиотерапии при метастатических поражениях печени через артериальный порт на фоне вариантов анатомии, когда правая печеночная артерия отходит от верхнебрыжеечной артерии, а левая печеночная артерия формируется в бассейне чревного ствола. У 2 пациентов выполнена транспозиция для восстановления кровотока. Варианты реконструкций магистральных венозных сосудов ГПБЗ представлены в таблице 3.
Таблица 3. Виды реконструкций магистральных вен при операциях на органах гепатопанкреатобилиарной зоны (n=46).
| Варианты реконструкций | Характер операции | Всего | |
|---|---|---|---|
| Панкреатодуоденальная резекция |
Резекция печени |
||
| Боковая пластика заплатой нижней полой и воротной вен | 4 | 7 | 11 |
| Протезирование нижней полой вены/воротной вены | 6/1 | 7/4 | |
| Краевая резекция нижней полой и воротной вен | 11 | 3 | 14 |
| Резекция ВВ с анастомозом конец в конец | 7 | 3 | 10 |
Как видно из таблицы, наиболее часто выполняли краевую резекцию НПВ и воротной вены, что объясняется определенной нерешительностью ангиохирургов на начальном этапе работы с сосудами ГПБЗ. В дальнейшем мы стали выполнять более сложные реконструкции, вплоть до протезирования НПВ и воротной вены.
Методы сосудистых реконструкций, выполненных в 2006-2012 гг. в РНЦРХТ при раке почки, представлены в таблице 4.
Таблица 4. Варианты оперативных вмешательств на сосудах
при местно-распространенном раке почки (n=46).
| Виды операций на нижней полой вене | Число больных |
|---|---|
| Тромбэктомия из нижней полой вены | 20 |
| Тромбэктомия + резекция нижней полой вены | 12 |
| Пластика нижней полой вены | 9 |
| Протезирование нижней полой вены | 5 |
| Всего | 46 |
Как видно из таблицы, наиболее часто выполняли простые тромбэктомии из НПВ, что обусловлено этапом накопления опыта. В дальнейшее стали прибегать к более радикальным, с точки зрения онкологии, и более целесообразным, с точки зрения гемодинамики, реконструктивным вмешательствам.
Экстренные сосудистые вмешательства на артериях нижних конечностей выполнены у 12 пациентов (бедренно-подколенный шунт – 4, аортобедренный – 8).
Плановые вмешательства при облитерирующем атеросклерозе сосудов нижних конечностей у онкологических больных в стадии устойчивой ремиссии основного заболевания выполнены у 99 больных (Табл. 5).
Таблица 5. Плановая сосудистая хирургия у онкологических больных.
| Диагноз | Операции | Число больных (n=99) |
|---|---|---|
| Облитерирующий атеросклероз сосудов нижних конечностей |
Аорто-бедренное бифуркационное шунтирование | 28 |
| Бедренно-подколенное шунтирование | 24 | |
| Петлевая эндартерэктомия из аорто-бедренного сегмента | 20 | |
| Аневризма аорты | Аорто-бедренное бифуркационное протезирование | 9 |
| Эндоваскулярное стентирование | 18 | |
| Всего | 99 | |
Как видно из таблицы, ангиохирургическая помощь онкологическим больным, страдающим облитерирующим атеросклерозом сосудов нижних конечностей, оказывали с использованием всего спектра современных сосудистых реконструктивных операций.
Результаты
Интраоперационная летальность при реконструкциях магистральных сосудов во время радикальных хирургических операций по поводу злокачественных опухолей органов ГПБЗ составила 0%. Одногодичная выживаемость больных – 70,4%. Отдельно анализ отдаленных результатов не проводили ввиду ограниченности периода наблюдения для основной массы оперированных пациентов.
Иллюстрация инвазии опухолью поджелудочной железы печеночных артерий и вен, а также этапы хирургического лечения представлены на рисунке 1.
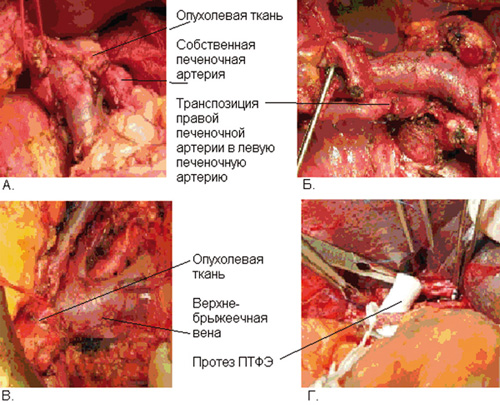
Рисунок 1. Поражение опухолью поджелудочной железы магистральных сосудов гепатопанкреатобилиарной зоны:
А – инвазия опухолью печеночной артерии; Б – правая печеночная артерия резецирована в пределах здоровых тканей, сформирован анастомоз правой и левой печеночных артерий по типу «конец в конец»;
В – инвазия опухолью воротной вены; Г – протезирование воротной вены.
При транспозиции правой печеночной артерии в левую печеночную артерию на этапе организации длительной региональной химиотерапии летальности не было. Артериальные порты функционировали во всем необходимом временном периоде. Иллюстрация этой технологии представлена на рисунке 2.
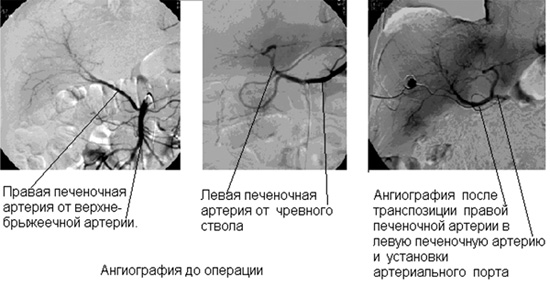
Рисунок 2. Бой С., 57 лет. Вариант анатомии и реконструкция артерий печени
для проведения эффективной длительной регионарной химиотерапии.
Реконструкции НПВ при местно-распространен-ном раке почки осложнились у одного (2,1%) больного тромбоэмболией легочной артерии (ТЭЛА) (была выполнена открытая тромбэмболэктомия из легочной артерии). Летальность составила 0%, одногодичная выживаемость – 84,7%.
Техника тромбэктомии и реконструкций НПВ во время операций по поводу рака почки представлена на рисунке 3.
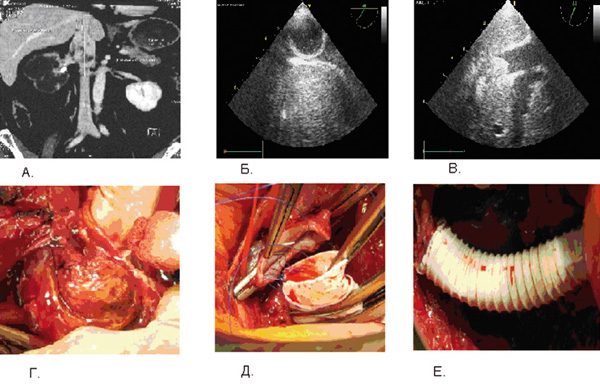
Рисунок 3. Реконструкции НПВ при местнораспространенных формах рака почки: А – визуализация тромба НПВ во время КТ ангиографии; Б – зонд тромбэкстрактор введен в правое предсердие (интраоперационное транспищеводное УЗИ);
В – процесс тромбэктомии (интраоперационное транспищеводное УЗИ); Г – экстракция тромба из просвета НПВ;
Д – формирование анастомоза НПВ и протеза ПТФЭ; Е – вид после протезирования НПВ.
Необходимо подчеркнуть, что все вмешательства на НПВ в нашем центре проведены при обязательном транспищеводном УЗИ контроле, что позволяет свести к минимуму риск ТЭЛА. Применение современных ПТФЭ протезов позволяет избегать тромбозов конструкций в послеоперационном периоде.
При реконструкциях магистральных артерий нижних конечностей у онкологических больных за 2006-2012 гг. отсутствовала госпитальная летальность. Среди осложнений было нагноение раны у 3 (2,7%) пациентов. Отдаленные результаты зависели от течения основного заболевания, но в целом соответствовали результатам реконструктивных операций на артериях у больных облитерирующим атеросклерозом сосудов нижних конечностей, не страдающих онкологическими заболеваниями.
Отдельно необходимо остановиться на эндоваскулярных стентированиях по поводу аневризм брюшного отдела аорты. Особенно показаны данные вмешательства онкологическим больным в стадии стойкой ремиссии, которые ранее перенесли неоднократные оперативные вмешательства на органах брюшной полости (Рис. 4).
Осложнений у больных в послеоперационном периоде не было. Госпитальная летальность составила 0%.
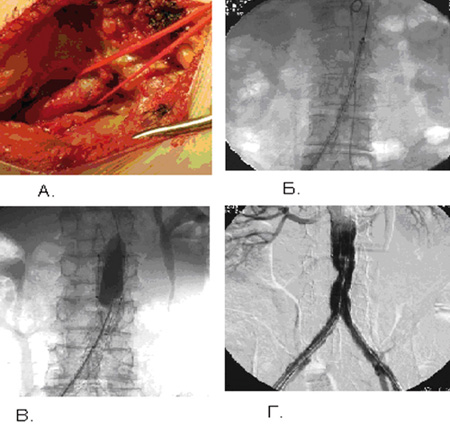
Рисунок 4. Этапы установки стентграфта в аорту:
А – доступ на бедренные артерии; Б – система доставки эндопротеза в аорту;
В – стентграфт раскрыт в аорте; Г – контроль установленной конструкции.
Обсуждение
В последнее десятилетие наблюдается отчетливая тенденция к изменению концепции хирургии местно-распространенных форм злокачественных опухолей ГПБЗ и почек, осложненных сосудистой инвазией. Это связано с совершенствованием хирургической техники, использованием современных пластических материалов, кровосберегающих технологий [2, 5, 8]. Немаловажную роль играют новые возможности комбинированного противо-опухолевого лечения, связанные с совершенствованием методов интервенционной радиологии, лучевой терапии и внедрением современных химиотерапевтических препаратов.
Сегодня сосудистая опухолевая инвазия не является принципиальным противопоказанием к удалению опухоли печени или поджелудочной железы, хотя решение о подобном вмешательстве остается индивидуальным. Что касается рака почки, то учитывая возможности сосудистой хирургии, необходимо подчеркнуть особую значимость рассматриваемой проблемы как пути однозначного расширения потенциала современной онкоурологии. Это полностью соответствует данным литературы [10].
Среди оперированных на ГПБЗ с реконструкцией магистральных сосудов гепатоцеллюлярный рак, по данным некоторых авторов, составлял около 30%, опухоли поджелудочной железы – 20%, холангиокарцинома – 22,7%, метастазы колоректального рака – 27,3% [2, 5]. Это обусловлено особенностями специализации клиник и хирургическими подходами к сосудистой реконструкции в зависимости от той или иной локализации опухоли ГПБЗ. В нашей серии операций, выполненных в 2006-2012 гг., сосудистые реконструкции чаще требовались при резекциях печени (55,4%). Мы реже прибегали к операциям на сосудах при радикальных вмешательствах на поджелудочной железе (44,6%). Таким образом, наши данные полностью согласуются с данными литературы.
При определении показаний к удалению опухоли поджелудочной железы изучали особенности сосудистой анатомии ГПБЗ, а также локализацию и степень сосудистой инвазии. Всем пациентам выполняли спиральную компьютерную томографию (КТ) с сосудистой реконструкцией и/или ангиографию. Инвазию общей печеночной и верхней брыжеечной артерий (ВБА) расценивали как противопоказание к радикальной операции, поскольку артериальная опухолевая обструкция является значимым негативным фактором прогноза отдаленной выживаемости [5]. Лишь в одном наблюдении артериальной инвазии мы выполнили резекцию и транспозицию правой печеночной артерии (ППА). Это диктовалось вариантом сосудистой анатомии – ППА отходила от ВБА и располагалась внутри опухоли. В другом случае была выполнена пластика чревного ствола по поводу ятрогенного повреждения в ходе операции.
Иной подход к определению тактики хирургического лечения злокачественных опухолей ГПБЗ сложился при венозной инвазии, не являющейся сегодня абсолютно значимым изолированным негативным фактором прогноза [5].
Данные о вовлечении в опухолевый процесс магистральных венозных стволов у больных с опухолью поджелудочной железы, полученные нами на этапе предоперационной диагностики, не всегда подтверждались хирургической ревизией: почти у половины больных при морфологическом исследовании удаленного препарата истинное опухолевое прорастание отсутствовало, а изменения сосудистой стенки были обусловлены близким расположением и компрессией опухолевых масс, а также паратуморальной воспалительной инфильтрацией. При анализе удаленных препаратов опухолей печени и желчных протоков специфическая инвазия НПВ или ВВ подтверждена во всех случаях. Необходимо отметить, что в абсолютном большинстве это были местно-распространенные гигантские гепатоцеллюлярные раки или опухоли, локализовавшиеся в непосредственной близости от ворот печени.
В доступной литературе приводятся сведения о резекциях НПВ при РП как in situ (6 больных), ante situ (24), так и ex vivo (22) [3]. Кроме того, имеются сообщения [7] о 4 наблюдениях резекций НПВ ex vivo и 9 – in vivo. Авторы [2, 8], выполнявшие резекции печени ex vivo, использовали протез Gore-Tex у 14 пациентов, резекцию и шов вены конец в конец – 6 раз, заплату Gore-Tex – 2 раза. Доля реконструкций НПВ при резекциях печени составляла от 8,2% [7] до 21,6% [5]. При вмешательствах на НПВ in vivo [7] синтетический протез применялся у 3 больных, аутовена – у 1, резекции без пластических материалов – у 3 , заплата – у 1.
По нашим данным, при операциях по поводу местно-распространенных форм злокачественных опухолей ГПБЗ и почки для реконструкции магистральных сосудов использовали как аутоматериалы, так и синтетические протезы. Надо отметить, что не все рассматриваемые ситуации были связаны с необходимостью полной поперечной резекции сосуда и дальнейшей его реконструкции. Почти все авторы отмечают, что при резекции воротной вены длиной до 4 см синтетические материалы не применяли. Наш опыт полностью согласуется с этими данными. Практически всегда ситуация позволяла нам при резекциях ВВ восстановить её проходимость анастомозом “конец в конец” без натяжения сосуда. Резекция магистральных сосудов при гастропанкреатодуоденальных резекциях составляет, по данным отечественных авторов, 11,2% [5]. Летальность на интраоперационном этапе при подобных вмешательствах колеблется от 4,6% [7] до 9% [2]. В ближайшем послеоперационном периоде от различных причин умирает еще до 9% пациентов. Кроме того, у 27,3% пациентов в ближайшем послеоперационном периоде встречается печеночная недостаточность [2, 6], у 9% – почечная недостаточность, требующая проведение гемодиализа [2]. В нашей серии интраоперационной летальности не было.
Эти сведения подтверждают мнение о том, что резекция и реконструкция сосудов не являются негативными факторами ближайшего прогноза для жизни при радикальных операциях по поводу злокачественных опухолей ГПБЗ.
На основании наших данных мы предполагаем, что сосудистая реконструкция не только не утяжеляет послеоперационное течение основного заболевания, но позволяет более радикально выпонять оперативное вмешательство по поводу злока-чественных опухолей ГПБЗ. С другой стороны, восстановление венозных и артериальных стволов реально облегчает течение ближайшего послеоперационного периода, уменьшая выраженность печеночной недостаточности и других осложнений, обусловленных нарушением местной микроциркуляции.
По сообщениям зарубежных гепатохирургов, осложнения в виде тромбозов протезов НПВ встречаются в 4,5%, что удается преодолеть эндоваскулярными методиками [2]. В ходе нашей работы специфических осложнений (аррозивное кровотечение, тромбоз конструкции и т. д.), связанных с сосудистыми реконструкциями в указанных зонах, нами не отмечено, несмотря на то, что в ряде случаев было местное подтекание желчи, эвакуируемое через адекватно установленные дренажи.
На наш взгляд, это наблюдение является принципиально важным, так как среди сосудистых хирургов бытует мнение об опасности контакта сосудистых конструкций с агрессивными биологическими средами (желчь, панкреатический сок, кишечное и желудочное содержимое), исключить который в абдоминальной хирургии не представляется возможным.
По данным гистологического исследования, лишь в 61,5% выявлена истинная инвазия опухоли в стенку магистрального сосуда. Необходимо отметить, что даже когда инвазии опухоли в стенку сосуда не было (почти в половине наблюдений), расширение объема операции можно считать оправданным с точки зрения абластики, радикальности и циторедуктивности.
Таким образом, сосудистая реконструкция позволила увеличить число пациентов, которым можно оказать помощь посредством высокотехнологичных методов лечения. Полученные данные позволяют констатировать, что вид реконструкции не имеет принципиального значения. По нашему мнению, вариант сосудистой реконструкции определяется только анатомо-топографической ситуацией в ране и принципом адекватности получаемой конструкции.
Приведенные данные и полученные нами результаты наглядно демонстрируют, что, несмотря на сложность вмешательства, тяжесть послеоперационного периода, операции по поводу местно-распространенных форм злокачественных опухолей ГПБЗ и почек, сочетанные с вынужденной реконструкцией магистральных сосудов, имеют право на жизнь.
Выводы
Использование сосудистых реконструктивных операций в онкологической практике позволяет расширить контингент больных, которым можно выполнить радикальное оперативное лечение, увеличить возможности циторедукции, которая при местно-распространенных формах рака в значительной мере повышает эффективность комбинированного лечения основного заболевания, а также повысить качество жизни онкологических больных.
Литература
- Мерабишвили В.М. Злокачественные новообразования в мире, России, Санкт-Петербурге. СПб. 2007; 37-153.
- Hemming AW, Reed MA, Langham MR, et al. Combined resection of the liver and inferior vena cava for hepatic malignancy. Ann Surg. 2004; 239: 712-721.
- Garcea G, Lloydb TD, Aylottb C, et al. The emergent role of focal liver ablation techniques in the treatment of primary and secondary liver tumours. Eur J Cancer. 2003; 39: 2150-216.
- Патютко Ю.И., Котельников А.Г., Косырев В.Ю., Сагайдак И.В. Пути улучшения переносимости гастропанкреатодуоденальной резекции. Хирургия. 2002; 10: 29-32.
- Douglas BE. Resectable pancreatic cancer: The role for neoadjuvant preoperative therapy. HPB. 2006; 8: 365-368.
- Oldhafer KJ, Lang H, Schlitt H, et al. Long-term experience after ex situ liver surgery. Surgery. 2000; 127(5): 521.
- Рeter J, Lodge A, Ammori Basil J, et al. ex vivo and in situ resection of inferior vena cava with hepatectomy for colorectal metastases. Ann Surg. 2004; 231 (4): 471-479.
- Raab R, Schlitt HJ, Oldhafer KJ, et al. Ex-vivo resection techniques in tissue-preserving surgery for liver malignancies. Arch Surg. 2000; 385: 179-184.
- Давыдов М.И., Матвеев В.Б. Хирургическое лечение больных раком почки с опухолевым тромбозом почечной и нижней полой вен. Онкоурология. 2005; 2: 8-15.
- Переверзев А.С. Хирургия опухолей почек и верхних мочевых путей. Харьков. 1997; 21-35.
